|
|
Surhet och syror
När vi biter i en citron eller i ett omoget äpple känner vi omedelbart att det smakar syrligt. Den sura smaken från en frukt kan ibland vara så kraftig att det känns obehagligt. Andra gånger smakar det bara syrligt och då kan det rentav vara en positiv upplevelse. Många tycker ju till exempel om syrligt godis. Den sura smaken kommer från syror. Det smakar surt på grund av syror
När vi upplever en sur smak så är det effekten av en syra vi känner. Sura vätskor finns överallt omkring oss. Den sura smaken beror på att smaklökarna på tungan reagerar på den sura vätskan och skickar en varningssignal till hjärnan. Citronsaft och ättika är två exempel på vätskor som smakar rejält surt. Andra sura vätskor smakar inte alls lika surt. Ett par exempel är läsk och honung. Det är faktiskt så att vissa typer av läsk är lika surt som citronsaft. Läsken innehåller dock socker som maskerar den sura smaken. Hjärnan upplever sötma starkare än surhet. Surheten finns där trots den söta smaken. Motsatsen till en syra är istället en bas.
pH-värdet är ett mått på hur sur eller basisk en vätska är
Syror är sura eftersom de lämnar ifrån sig vätejoner (H+). En vätejon är en positivt laddad väteatom. Vi upplever sur smak eftersom våra smaklökar känner av förekomsten av vätejoner. Ju högre koncentration av vätejoner, desto surare känns det. pH-värde är ett sätt att ange hur sur en lösning är. Rent vatten är vare sig surt eller basiskt. Det är neutralt och har pH-värdet 7. En sur lösning har ett lågt pH-värde. Sura lösningar har alltså pH-värden som är lägre än 7. En basisk lösning har ett högt pH-värde. Basiska lösningar har pH-värden som är högre än 7.
Vätejonkoncentrationen är direkt kopplad till pH-värdet. En lösning med hög vätejonkoncentration har ett lågt pH-värde och är alltså sur. Förhållandet mellan vätejonkoncentrationen och pH-värdet är logaritmiskt. Om pH-värdet sjunker en enhet innebär det att vätejonkoncentration har ökat 10 gånger.
Surhet uppkommer då syror ger ifrån sig vätejoner. pH-värdet går att mäta på olika sättAtt använda smaken för att bestämma om något är surt är inte särskilt effektivt och kan vara direkt farligt. Med hjälp av ett mätinstrument som kallas en pH-meter kan vi i stället mäta pH-värdet och förstå hur sur lösningen är. Det är koncentrationen av vätejoner som pH-metern reagerar på. Genom att veta koncentrationen får vi direkt ett värde på surheten.
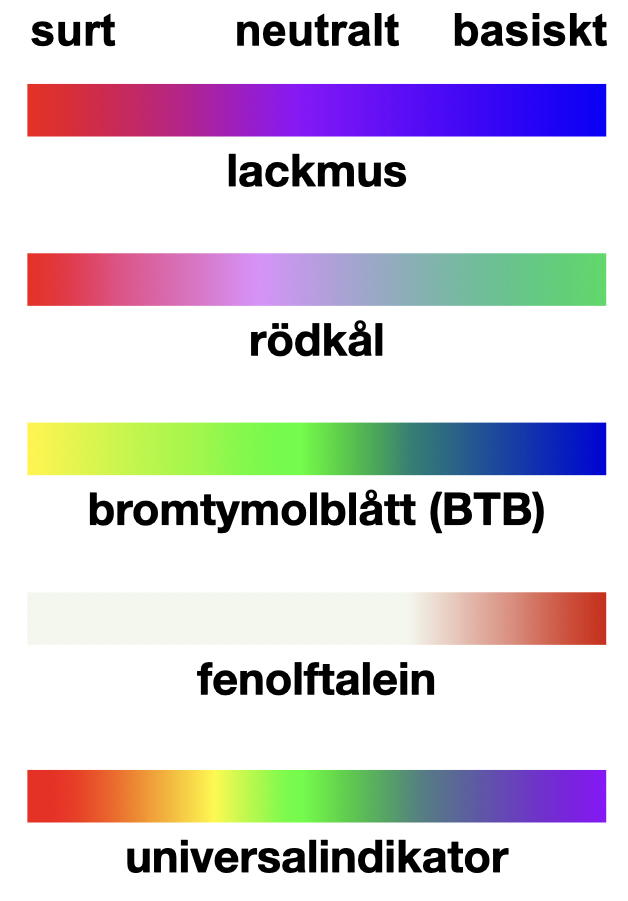
Ett annat snabbt och enkelt sätt att avgöra hur sur en lösning är, är att använda en pH-indikator. I filmen används en universalindikator. En pH-indikator är ett ämne som har olika färg vid olika pH-värden. pH-indikatorer finns som vattenlösningar, men även som stickor av plast eller papper. En droppe av en pH-indikator färgar lösningen och avslöjar om den är sur, neutral eller basisk. pH-papper eller pH-stickor kan innehålla områden med flera pH-indikatorer. Genom att doppa stickan i en lösning och observera färgomslagen hos de olika pH-indikatorerna går det till och med att avgöra ungefär vilket pH lösningen har. Vi utnyttjar då att olika indikatorer byter färg vid olika pH.
Olika typer av pH-indikatorer
Olika syror är olika starkaSyror är alltså ämnen som kan lämna ifrån sig vätejoner till en vattenlösning. Syror kan vara olika starka. En stark syra är ett ämne som lämnar ifrån sig många vätejoner och som därmed ger en hög vätejonkoncentration och ett lågt pH i vattenlösning. En svag syra ger färre vätejoner. Det som påverkar pH i en lösning är alltså både mängden syra som löses upp och vilken typ av syra det är. Vi kan alltså påverka pH-värdet genom att välja en lämplig syra, men också genom att kontrollera mängden syra i lösningen.
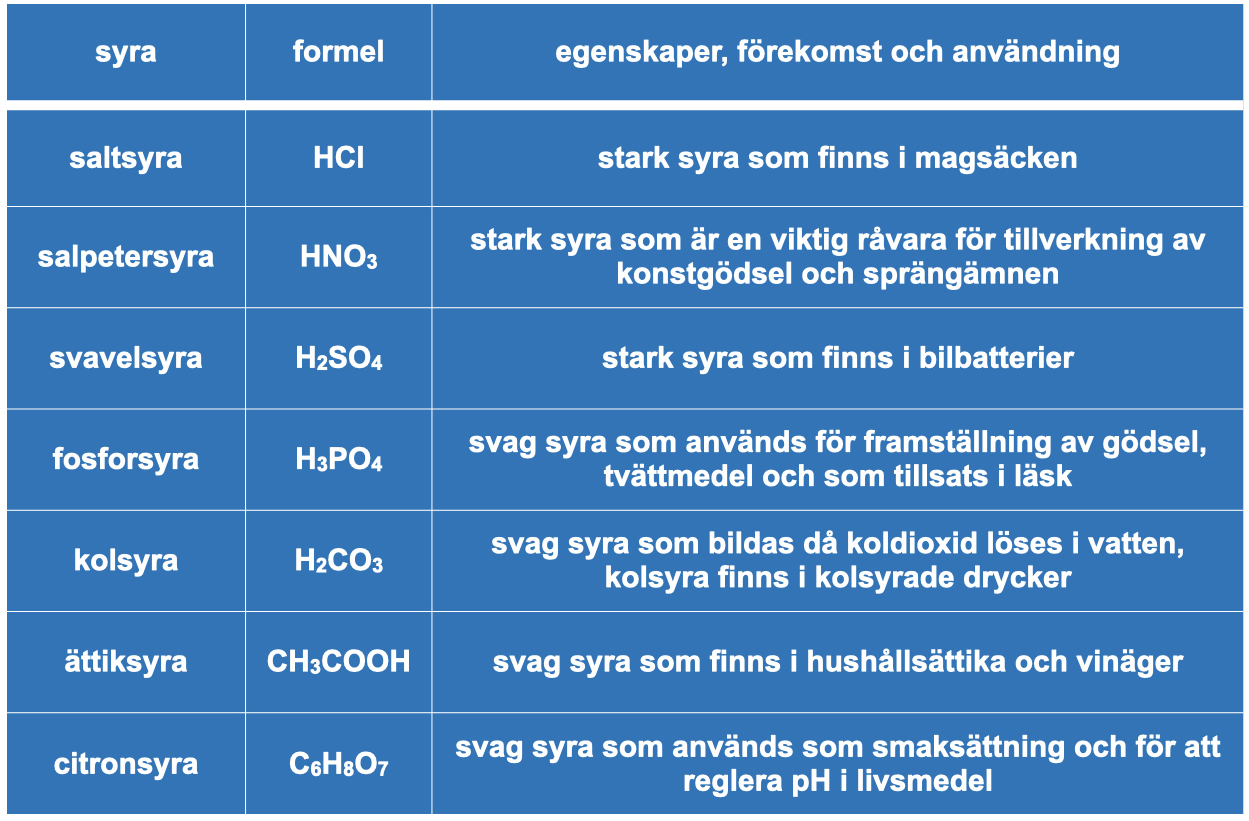
Ett sätt att få önskad koncentration av vätejoner är att späda en koncentrerad syralösning. Det gäller att vara försiktig, särskilt om vi arbetar med starka syror. När syran späds ut blir det varmt och i värsta fall kan det bli så varmt att lösningen börjar koka. Då finns en risk att frätande syra stänker. Detta undviker vi genom att alltid lösa en liten mängd syra i taget i en större volym av vatten. Minnesregeln för detta brukar kallas SIV-regeln. SIV står för Syra I Vatten. Om vi häller i syran långsamt blir värmeutvecklingen kontrollerbar och risken för stänk minimeras. Vi använder många olika syror i vardagslivetSyror är viktiga och har många användningsområden. Generellt används syror ofta som råvaror för framställning av andra ämnen. De sura egenskaperna gör också att de kan användas för rengöring, till exempel för att lösa upp kalkavlagringar. Några exempel på viktiga syror är:
Basiska lösningar innehåller hydroxidjoner som kan neutralisera syror
Lösningar som har ett pH-värde högre än 7 brukar kallas basiska. Basiska lösningar är motsatsen till sura lösningar. För att en lösning ska vara basisk krävs hydroxidjoner (OH–). Om vi vill minska surheten hos en sur lösning kan vi tillsätta en bas. Hydroxidjonerna reagerar med vätejonerna i den sura lösningen och bildar vatten. Om vi har precis lika mycket bas som syra säger vi att lösningen är neutral. Då bildas vatten och ett salt. Om vi låter saltsyra (HCl) och basen natriumhydroxid (NaOH) reagera, får vi en lösning av vanligt bordssalt i vatten.
Precis som det finns svaga och starka syror finns det svaga och starka baser. En stark bas ger en hög koncentration av hydroxidjoner när den löses upp i vatten. Bland de starka baserna hittar vi natriumhydroxid (NaOH) och kaliumhydroxid (KOH). Natriumhydroxid stöter vi på till exempel som ingrediens i propplösare. Natriumhydroxid kallas ibland för kaustiksoda.
En av de vanligaste svaga baserna är ammoniak (NH3) som används som rengöringsmedel och som råvara för framställning av andra kemiska föreningar. När ammoniak löses upp i vatten tar den en vätejon från vatten och då bildas hydroxidjoner.
En vattenlösning av en stark bas kallas ofta för lut. Detta namn återkommer i ordet lutfisk. Lutfisk tillagas av torkad fisk som blötläggs i en basisk lösning som består av natriumkarbonat (Na2CO3) och kalciumhydroxid (Ca(OH)2). Därefter tvättas fisken och kokas. Ibland får vi halsbränna. Då läcker magsyra från magsäcken ut i matstrupen. Då kan vi dricka en svagt basisk lösning av bikarbonat (NaHCO3) som hjälper till att neutralisera syran. Starka syror och baser är frätandeSyror är frätande ämnen och ska därför hanteras försiktigt. En frätskada liknar ett brännsår. Ju högre vätejonkoncentrationen är, desto större är risken för en frätskada. Därför är det särskilt viktigt att vara försiktig om vätejonkoncentrationen är hög. Även starka baser är frätande och ska hanteras varsamt. Om vi kommer i kontakt med syra eller bas gäller det att snabbt skölja med mycket vatten. Svavelsyra reagerar dessutom häftigt med material som innehåller kolhydrater. Om vi skulle droppa svavelsyra på en bit papper kommer det bildas ett svart hål. Det är svavelsyran som reagerar med cellulosa och förvandlar den till kol. Många syror kan också fräta sönder metaller.
Olika delar av kroppen har olika pH. I magsäcken finns saltsyra som ger ett pH mellan 1,5-2. Den sura miljön i magen hjälper till med matspjälkningen och skyddar mot maginfektioner. Andra kroppsvätskor är ofta nära neutrala. Blod har ett pH på cirka 7,4. För att vi ska må bra krävs att detta pH hålls konstant. Även små förändringar i pH gör oss sjuka.
Supersyror är otroligt starka syrorDet finns också så kallade supersyror. De är ännu starkare än starka syror som saltsyra och svavelsyra. Den starkaste supersyra vi känner till idag är fluorantimonsyra. Den är flera miljarder gånger surare än svavelsyra. Den fräter till och med sönder glasflaskor. Kemisten George Olah fick nobelpriset i kemi 1994 för sin forskning kring bland annat supersyror. Supersyror används bland annat för att tillverka olika former av bensin.
Quiz - Surhet och syrorUppgifter - Surhet och syror
Förklara och beskriv
Argumentera och resonera
Ta reda på
|